En un avance notable, científicos afiliados a la prestigiosa Universidad de Harvard han concebido una innovadora herramienta impulsada por la Inteligencia Artificial, la cual despliega la capacidad de discernir entre subtipos de gliomas y potenciales mutaciones presentes en los tejidos tumorales durante el transcurso de una cirugía.
La instauración de esta inteligencia artificial en el diagnóstico intraoperatorio de gliomas, una forma prevalente de tumor cerebral, procura arrojar una influencia sustantiva en la toma de decisiones en el marco del abordaje quirúrgico de pacientes aquejados. La información derivada del diagnóstico molecular de gliomas, al tener el potencial de proveer precisiones adicionales, emerge como una contribución de envergadura al enfoque quirúrgico de la condición.
Este enfoque pionero, ilustrado en el contexto de una cirugía de extirpación tumoral, adquiere distintos matices en virtud de la información molecular adquirida. Ante un diagnóstico genético que infiera un curso poco agresivo del tumor, el cirujano puede atinadamente ajustar el grado de resección tisular con la mira de minimizar posibles daños neurológicos colaterales. En contraste, un diagnóstico que identifique un tumor agresivo insta a una resección exhaustiva, con miras a evitar la presencia residual de tejido propenso a proliferar.
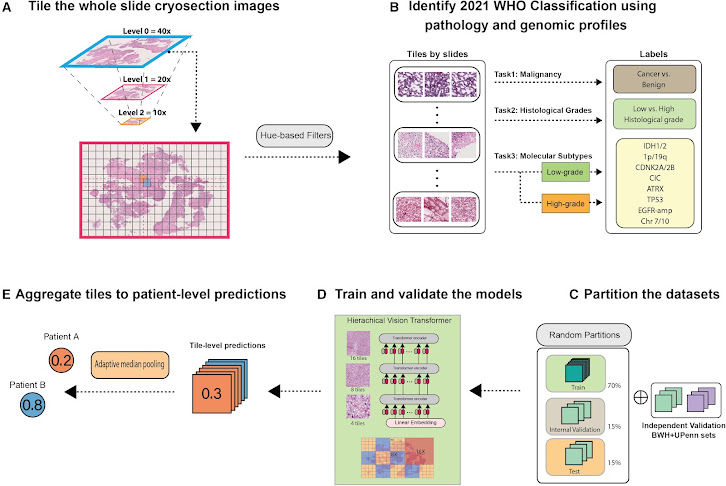
La práctica convencional para adquirir datos directos del tumor, con la finalidad de influir en la orientación del enfoque quirúrgico en gliomas, supone la extracción de una muestra tisular en el transcurso de la intervención, seguida de su congelación y la preparación de secciones para análisis. Sin embargo, esta táctica exhibe limitaciones técnicas, tales como la susceptibilidad a la generación de artefactos durante el proceso de congelación. Además, no faculta una caracterización molecular integral, un requisito vital para el diagnóstico conforme a los últimos sistemas de clasificación.
"Hasta el momento presente, inclusive las formas clínicas más avanzadas no logran realizar una caracterización molecular en tiempo real durante el acto quirúrgico", puntualiza Hun-Hsing Yu, investigador de la Facultad de Medicina de Harvard y director de la investigación, documentada en la revista "Med". "Nuestra creación dirime este desafío, extrayendo señales biomédicas subyacentes de las muestras patológicas preservadas en estado congelado".
Inteligencia Artificial en la Caracterización de Gliomas
En aras de optimizar la información extraída durante la intervención, el equipo de investigadores ha engendrado una herramienta con la pericia de discernir tumores portadores de mutaciones específicas con un nivel de precisión alcanzando un 93%. Adiestrada con 2334 muestras tumorales procedentes de 1524 individuos, la herramienta emprende un análisis visual de las preparaciones, orquestando la clasificación del tumor en tres clases primordiales de gliomas. Esta diferenciación ostenta una relevancia de calado, en tanto que cada categoría se adscribe a un pronóstico y enfoque terapéutico diferenciados.
Denominado CHARM (acrónimo de Evaluación Histopatológica de Criosección y Revisión de Máquina), este artilugio ostenta la capacidad de divulgar otras categorías de información de alcance significativo. A través de la evaluación de los márgenes tumorales, CHARM logra discernir la presencia de proliferación celular y la agresividad del glioma. Adicionalmente, ofrece una visión detallada de la morfología celular y del espacio extracelular, un nivel de percepción más allá del umbral de la capacidad visual humana.
Implicaciones para la Oncología de Precisión
Las deducciones derivadas del diagnóstico molecular proporcionado por CHARM tienen el potencial de empoderar a los cirujanos con decisiones de mayor precisión. Aparte de guiar la determinación de la cuantía de tejido tumoral sujeto a extracción, el perfil molecular puede reverberar en el enfoque terapéutico mismo, considerando la posibilidad de terapias dirigidas administradas in situ durante la cirugía. "La competencia de deducir el diagnóstico molecular en tiempo real, inmerso en el acto quirúrgico, ostenta la capacidad de catalizar el avance de la medicina de precisión en un ámbito temporal inmediato", observa Yu.
Previo a su inserción en la práctica clínica, la validez de CHARM, al ser proporcionada libremente a otros investigadores, necesita ser corroborada. Adicionalmente, esta herramienta deberá ser objeto de actualizaciones regulares a medida que el cuerpo de conocimiento en torno a esta forma particular de cáncer continúe ampliándose.
¿Cómo es el procedimiento técnico?
Fuente Imagen: Machine learning for cryosection pathology predicts the 2021 WHO classification of gliomaPublished:July 07, 2023DOI:https://doi.org/10.1016/j.medj.2023.06.002
Bibliografía y Recursos Consultados
- Machine learning for cryosection pathology predicts the 2021 WHO classification of glioma
- AI Tool Decodes Brain Cancer’s Genome During Surgery
- Application of artificial intelligence in glioma researches: A bibliometric analysis
- Artificial-intelligence-based molecular classification of diffuse gliomas using rapid, label-free optical imaging




No hay comentarios:
Publicar un comentario